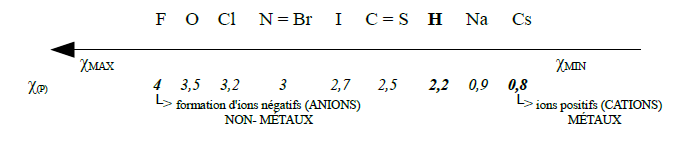La périodicité des propriétés chimiques
Quelle est l'origine du tableau périodique de Mendeléev ?
└> constat de données expérimentales : si on range les éléments par ordre croissant de masse (atomique), les mêmes propriétés réapparaissent périodiquement
└> classement en lignes/colonnes
périodes familles ou groupes
Cause ? Structure électronique des atomes (Chapitre VII)
└> Conséquences majeures sur le réactivité de éléments
Groupes 1 et 2
|
Groupe 1 ALCALINS |
Groupe 2 ALCALINOS-TERREUX |
|
Li – Na – K – Rb – Cs cations M+ Métaux très réactionnels
Composés avec O2 H2O M2O → MOH oxyde hydroxyde H2 hydrure MH X2 halogénure X- MX réaction avec l'eau M + H2O → hydroxyde + H2 |
Be – Mg – Ca – Sr – Ba cations M2+ Métaux un peu moins réactionnels
H2O MO → M(OH)2 oxyde hydroxyde H2 hydrure MH2 MX2
idem |
Règle générale : les éléments appartenant à un même groupe possèdent des propriétés fort semblables.
Les halogènes (groupe 17) et les gaz rares (groupe 18)
Groupe 17 : halogènes : F – Cl – Br – I
-
anions X-
-
Non-métaux diatomiques X2
F2 – Cl2 – Br2 – I2
-
très réactionnels, surtout les plus légers (fluor >>> chlore > brome > iode)
Groupe 18 : Gaz rares : He, Ne, Ar, (Kr, Xe, Rn)
-
très peu réactionnels, quasi inertes
-
très stables
Le concept d'électronégativité
Na → Na+ ≡ Ne
Z=11 Z=11 Z=10
11p+ 11p+ 10p+
11e- 10 e- 10e-
Constat : tendance marquée des éléments pour former des ions isoélectroniques avec le gaz rare le plus proche
-
Concept d'électronégativité : mesure de la tendance qu'a un atome dans un composé, à attirer vers lui les électrons
-
Échelle empirique de Pauling - χ(P)