Lavoisier (1743-1794)
Lavoisier est un chimiste français. Il est appelé le père de la chimie moderne. Il a découvert la loi de la conservation de la masse (qu'il appelait loi de la conservation de la matière, ce qui n'est pas tout à fait vrai).
L'expérience qu'il a réalisé est la suivante : il a étudié l'oxydation du mercure dans un système fermé et il a observé que la masse totale des produits formés (en l'occurrence l'oxyde de mercure) est égale à la masse des réactifs consommés (ici l'oxygène et le mercure).
Il émet donc la règle suivante « Rien ne se perd, rien ne se crée » (ce qui n'est pas tout à fait exact comme nous le verrons par la suite), c'est ce que l'on appelle le bilan de la matière. Il est important de toujours vérifier le bilan de matière d'une réaction chimique pour déceler la présence d'erreurs de calculs.
Proust
Proust est un autre chimiste français. Il a émis la loi des proportions définies. Dans un composé donné, les éléments sont toujours combinés dans les mêmes proportions massiques.
Pour vérifier cette affirmation, Proust a également réalisé une expérience. Il a oxydé une masse donnée de magnésium avec une masse donnée d'oxygène. Les résultats de son expérience sont repris dans le tableau suivant :
|
m(g) |
Mg |
O |
On obtient |
Mg |
O |
MgO |
Rapport Mg/O de ce qui a réagi |
|
50 70 50 70 |
25 25 50 46,1 |
|
12 32 - - |
- - 17,1 - |
63 63 82,9 116,1 |
38/25 = 1,52 38/25 = 1,52 50/32,9 = 1,52 70/46,1 = 1,52 |
Dalton
Dalton est un chimiste britannique. Il a émis la loi des proportions multiples. Elle s'énonce comme suit :
« Quand des espèces chimiques (éléments) s'associent pour former des espèces différentes (composés différents), les masses de l'une qui se combinent à une même masse de l'autre sont toujours dans le rapport de nombres entiers simples ».
Illustrons cette loi par un exemple :
L'oxygène peut se lier au carbone pour former deux molécules différentes : le monoxyde de carbone et le dioxyde de carbone, analysons les rapports des masses qui réagissent respectivement :
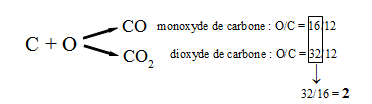
Cette loi valide la structure discontinue de la matière. Le rapport des masses qui régissent entre elles ne peuvent prendre que certaines valeurs.
Il existe une échelle relative, l'échelle des masses atomiques (« u.m.a. » ou « u »)
Exemple : H : 1,008 u C : 12,011 u Cl : 35,455 u
Constitution de l'atome
Thomson
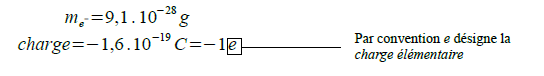
Thomson est un chimiste britannique qui a découvert l'électron en 1897. Il a étudié des rayons cathodiques (comme ceux qui assuraient le fonctionnement des anciens téléviseurs cathodiques). Il les fit passer entre deux conducteurs entre lesquels il y avait une différence de potentiel. Il observa ainsi que les rayons cathodiques contenaient des particules chargées négativement, identiques pour tous les éléments. Ce sont ces particules chargées négativement que l'on appelle électrons. On les désigne par le symbole suivant : e- .
L'américain Millikan réalisa des mesures précises de la déviation des électrons au travers d'un champ électrique et il put ainsi en déterminer la masse et la charge qui sont reprises ci dessous :
Or, sachant que les atomes sont neutres, et que les électrons sont chargés négativement, il va de soi qu'il existe au sein de l'atome une ou des particules chargées positivement.
Rutherford (1908)
Rutherford a réalisé une expérience qui consistait à bombarder une feuille d'or avec des particules α, qui sont des particules radioactives (la radioactivité a été découverte par Becquerel en 1896) chargées positivement.
Par cette expérience il a remarqué que presque toutes les particules α ont réussi à traverser la feuille d'or sans rencontrer d'obstacle. Par contre, une petite partie des particules α (environ 1/20.000) a été ont rencontré un obstacle chargé positivement car elles ont été déviées de leur trajectoire en rencontrant la feuille d'or.
Les particules α on donc été déviées par d'autres particules positives des très petite dimension par rapport à l'atome (environ 10-5 fois plus petites que l'atome).
Ce reste positif contenu dans l'atome se situe dans le noyau, ce sont les protons. On les désigne par le symbole p+.
La masse du proton et le rapport entre la masse du proton et de l'électron sont repris ci-dessous :
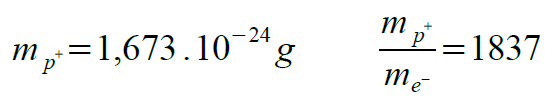
Le rapport entre la masse du proton et de l'électron démontre bien que la somme de la masse des électrons de l'atome est négligeable par rapport à somme des masses des protons de l'atome.
On peut donc en conclure, puisque la somme de la masse des électrons est négligeable par rapport à celle des protons, que la masse de l'atome est plus ou moins égale à la masse du noyau.
Le diamètre de l'atome est de l'ordre de 10-9 m, soit un nm (c'est le domaine de la nanoscience, de la nanotechnologie et des nanomatériaux qui font partie des sciences modernes). Le diamètre du noyau est de l'ordre de 10-14 m, soit environ 10-5 fois plus petit que l'atome.
Chadwick (1932)
L'anglais Chadwick a découvert l'existence du neutron, le deuxième constituant du noyau de l'atome. Celui-ci a une masse comparable (mais légèrement supérieure) à celle du proton. On le désigne par le symbole n.
On désigne par Z le numéro atomique de l'élément. Il correspond au nombre de protons dans le noyau et au nombre d'électrons autour du noyau de l'atome neutre (il ne désigne donc pas le nombre d'électrons dans un ion). Le numéro atomique correspond au numéro de la case de l'élément dans le tableau périodique. En connaissant Z on peut donc savoir de quel élément il s'agit (par exemple : Z=6 → carbone ; Z=26 → fer).
On désigne par A le nombre de masse, celui-ci correspond à la somme du nombre de protons et d'électrons de l'atome.
Voici un tableau récapitulatif des notions précédentes :
-
particule
charge
masse
nombre
proton
+ e
1,67.10-24 g
Z
neutron
0
A-Z
électron
- e
9,1.10-28 g
Z
Les isotopes
En faisant passer du néon dans un spectromètre de masse, on observe qu'il emprunte trois trajectoires différentes. Il existe donc du néon de trois masses différentes. On dira donc qu'il existe trois isotopes du néon. On appelle isotope les atomes d'un même élément (même Z) qui diffèrent par leur nombre de neutrons.
Le tableau suivant reprend les différents isotopes du néon :
-
Ne
A
Z
A-Z
m =
20
10
10
m =
21
10
11
m =
22
10
12
Les proportions dans lesquelles les différents isotopes d'un même élément sont présents est appelée abondance naturelle. Celle-ci est déterminée par expérience.
